

1.日本における後発医薬品の原薬調達状況
図1は後発医薬品の原薬調達状況を示したものですが、国内製造は36%に留まり、約6割は輸入に頼っていることが分かります。主な原薬調達先として中国、インド、韓国、イタリア等が挙げられます。参考までに地域別の医薬品原薬生産額を比較したのが左下の表ですが、中国、インドでは合計270万ドル、ヨーロッパで120億ドル製造されているものの、日本は年間30億ドルにとどまり、北米も25ドルと、日米とも医薬品原薬は輸入に頼っていることが分かります。
すなわち、原薬を安定して調達するためには、インドや中国等の国々から、いかに安定して調達するかが重要となるということができます。
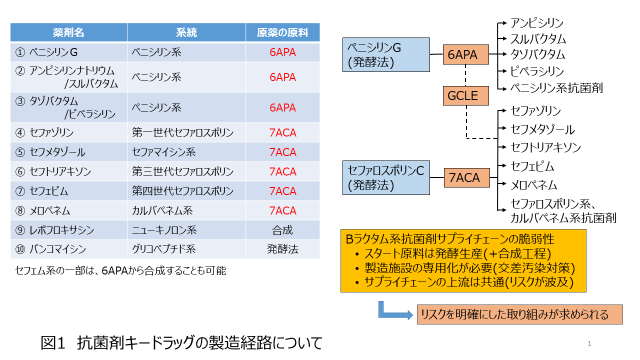
図2には、2020年に感染症関連の4学会が一昨年、抗菌剤キードラックの案として提案した10種の抗菌剤について、その系統、及び原薬製造の出発原料を示しました。10の抗菌剤のうち8薬剤がベータラクタムで、ペニシリン系が3薬剤、セファロスポリン系が5薬剤でした。図の右側に示したように、ペニシリン系の薬剤はペニシリンGから作られる6APAを出発原料として、それぞれいろいろな側鎖が付けられて合成されます。一方セファロスポリン系やセファマイシン、カルバペネム系抗菌剤は、セファロスポリンから作られる7ACAを出発原料として合成されます。また、最近では6APAからGCLEという中間体を経て7ACAが合成されるルートも開発されており、こちらの方が一般的になりつつあるともいわれています。すなわち、10のキードラッグのうち、8つまでが6APAまたは7ACAから製造されており、6APA、7ACAの安定的な供給が欠かせないと言うことが出来ます。
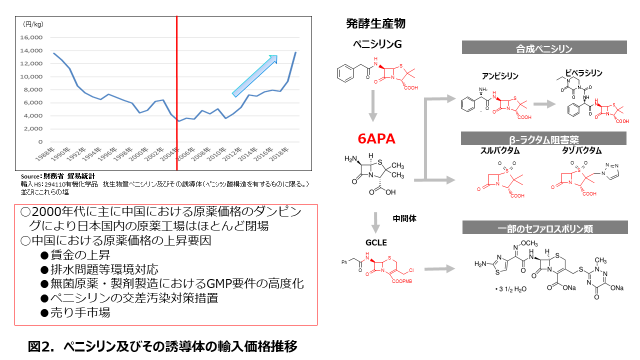
図3にはペニシリン及び誘導体の輸入価格推移を示していますが、2000年頃に安価な中国産原薬が大量に供給されたことで、日本の原薬製造は競争力を失い、日本国内の原薬の製造工場の殆どはこの時期に閉鎖されてしまいました。
また、ペニシリンやセファロスポリンのようなベータラクタム系抗菌剤は専用の施設で製造が求められるものの、価格が安価のため製造を撤退する企業も多く、6APAや7ACAといった原薬の原料を供給する製造所は世界でも数社に限られています。また、その殆どが中国企業であることも、これら抗菌剤のサプライチェーン上の特徴でもあります。
一方。安価であったはずの中国産の原薬においても近年の中国での人件費の上昇や、環境対策費用、GMP要件の高度化、製造所の集約による売り手市場により、価格の上昇が続いていいます。

一方、図4にあるように、最大の原薬製造国の一つである中国では、2015年に新たな環境保護法が施行され、中央環境監査が開始された以降、法執行が厳格化され、処罰件数が増加しており、排水や排気のレベルが指定された期限内に規制に適合できなかった製造所は操業停止に追い込まれたり、排水を当局が常に監視し、規制値に適合しない場合は即座に送電を止められるなど、原薬の安定供給に支障が出るケースが発生しています。またペニシリン類の製造施設は専用化が求められているうえ、発酵生産は排水等の制限の関係で、中国東北部の農村部に集約されて巨大化し、売り手としてのパワーが強大化するなどの課題も生じています。


また、図5を見ていただくとわかるように、2015年の中国・天津の大爆発ではB型慢性肝疾患治療薬の製造・出荷が停止され、更に2019年4月には、中国・山東省済南市の製薬会社の火災で、後発医薬品「タゾピペ配合静注用」の供給が滞り、その影響で火災を起こした製薬会社以外から原薬を調達しているメーカーも含めて供給不安が生じるなど、事故や災害も安定供給に対するリスク要因の一つと言えます。
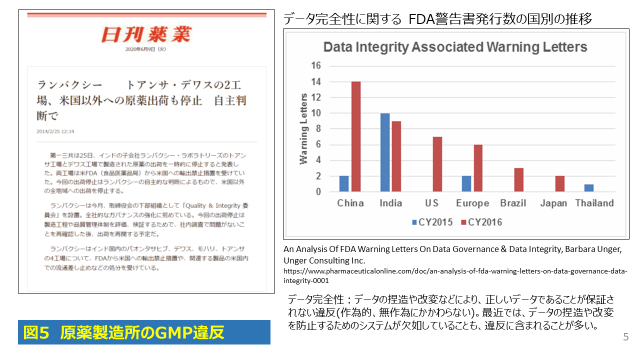
一方、最近インド、中国等の製造所に対するFDA等の欧米当局の査察で、製造や品質試験データの完全性に関する不適合、すなわち、データの捏造や改変が発見された結果、その製造所のすべての記録や試験結果の信頼性が疑われ、査察対象のみならず、当該の製造所で製造されている全ての製品が出荷できなくなるなどの事象も、安定確保の大きな阻害要因となっています(図5参照)。
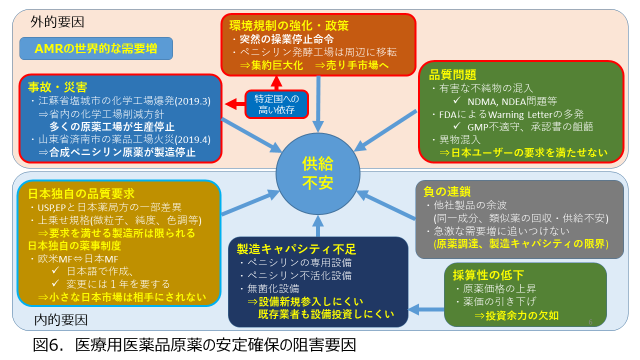
図6には、医療用医薬品原薬の安定確保の阻害要因についてまとめました。まず外的要因として、先に説明したように「環境規制の強化」、「事故・災害」が挙げられます。更に最近のニトロソ化合物の副生や、異物の混入のような品質問題やGMP違反などによる製造停止措置などが挙げられます。
一方、内的要因としては、日本独自の品質要求や、日本独自の薬事制度への対応への困難さが挙げられます。この後、詳しくご説明しますが、これが日本の製薬企業のバイイングパワーの低下要因の一つとなっています。また製造キャパシティ不足の問題、これは特に専用設備や廃液等の不活性化が求められるペニシリン類や無菌原薬などが該当しますが、専用設備が必要なため新規参入も困難であり、採算性の問題もあり、なかなか解消しにくい課題ではあります。またそれに関連して、一つの製品が供給不安や回収になると、代替え薬に指定された同一成分や類似薬が需要増に追いつけずに供給不安となる、負の連鎖等も阻害要因として挙げることが出来ます。
2.日本における後発医薬品の安定供給に関する取り組み
図7. には、日本における後発医薬品使用促進策の経緯をまとめました。ジェネリック医薬品の使用促進策に関連して、厚生労働省は平成25年に「後発医薬品のさらなる使用促進のためのロードマップ」を策定し、それを受けて、日本製薬団体連合会(以下、日薬連)では、平成26年に「ジェネリック医薬品安定供給ガイドライン」を策定して、後発医薬品を製造販売する各社に対して、「安定供給マニュアル」を作成して、医薬品の製造販売業者として安定供給の責任を果たすことを求めました。

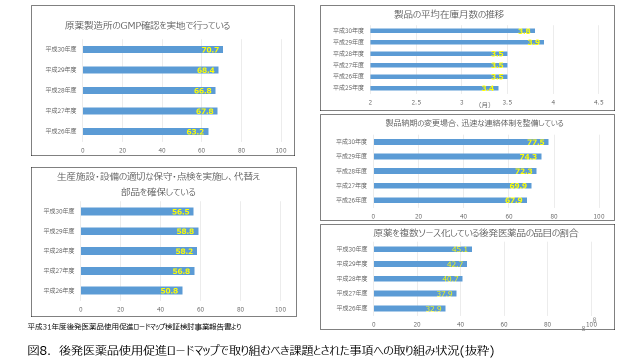
図8には、後発医薬品使用促進ロードマップで取り組むべき課題とされた事項への取り組み状況を抜粋して示しました。具体的には、原薬の安定確保の手段としてロードマップで努力目標とされた事項について、年度ごとの達成状況の推移です。各社とも原薬製造所の製造管理及び品質管理の実地による確認や、生産施設・設備の適切な保守点検、在庫の積み上げ、原薬の複数ソース化等の対応等に取り組んでおり、安定供給の実現に向けて努力をしていることが分かります。にもかかわらずいまだに原薬に起因した供給不安が発生しているのはご存知の通りです。特に約8割の後発品メーカーが原薬の複数ソース化に精力的に取り組んでいるにもかかわらず、日本の品質要求に適合する原薬を供給できる製造所が限定されるケースも多く、複数ソース化ができていいないものも多いのが現状です。
これらの状況を踏まえ、実際に供給不安が生じた際に、各社が適切に対応をとれるよう、日薬連では安定供給に関するチェックリストを作成し、各社間で共有することで問題意識レベルの共有やリスクの見える化への取り組みを行っています(図9参照)。
このチェックリストは、原薬製造業者の評価や、当該原薬のサプライチェーンの状況等の設問で、原薬等の安定調達の確保に関するリスクを「見える化」する「チェックリスト1」と、医薬品の医療上の必要性に関する評価項目で、もし欠品した場合の、医療機関への影響を「見える化」する「チェックリスト2」の2つのチェックリストから構成されています。
このチェックリストを活用することで、各社の供給不安に対する意識レベルを合わせ、また潜在するリスクを早期に発見することで迅速なアクションに結び付けるとともに、供給不安を起こさせない努力の必要性や、供給不安が生じた際にも医療機関へ早期に連絡ができるような体制を構築できることが期待されています。

更に、日薬連では、製薬各社にそのチェックリストを活用した自己点検の実施を促し、リスクを見える化して早期の課題発見につなげるとともに、供給不安のおそれが生じた場合には、原薬の早期の確保、品質問題の場合は原薬製造所の技術指導による品質の安定化や増産の対応の予防策の実施につなげ、更に欠品のリスクがぬぐい切れない場合には、早期に医療機関への情報提供を促すなどの取組みも行っております。具体的な進め方として、図10.に、2019年7月に日薬連から各製薬団体・会社に通知し、対応を要請した「医薬品の安定供給に関する自己点検の実施について(日薬連発)」の概要を示しました。

3.医薬品原薬の安定確保のための行政への要望
日薬連ではこのような施策をとおして、医薬品原薬の安定確保に対する取り組みを実施しているところですが、更に原薬の安定確保を進めるには、これをサポートする国の施策も必要と考えます。図11. 及び図12.に、医薬品の安定確保に向けた課題と対応策についての一案を示しました。コロナによる海外原薬の生産国による囲い込みや、東アジア情勢の不透明化などのリスクも潜在化しており、6APAや7ACAβのようなβラクタム系抗菌剤の原料のように製造業者が世界でも数社に限定されるような場合は、国内生産などの抜本的な対策も必要と考えます。
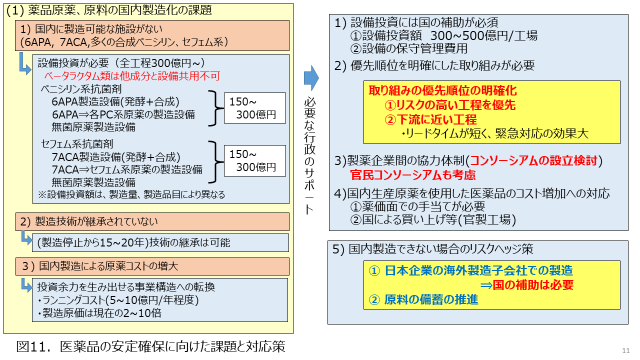
βラクタム原料の国内製造については、まずは設備投資面でのサポートは必須と考えられます。2020年度より原薬国内製造に向けた設備投資への助成が開始されたと伺っておりますが、現在日本で製造されていないベータラクタム原料を製造するには数百億単位の設備投資が必要となりますので、さらなる助成の拡大が望まれます。また、国内製造による原薬コストの増大も考慮する必要があります。外国産に比べて価格面で不利となりなすので、官民のコンソーシアム設立など、運転コストのサポートや、原薬の買い取り制度などの施策も具体的に検討する必要があるのではないかと思います。
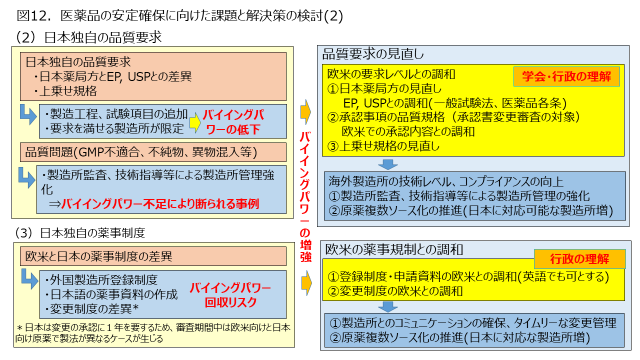
加えて、欧米との品質規格及び薬事規制の調和により、海外原薬製造所の日本への販売意欲を高める取り組みも重要と考えます(図12)。日本独自の品質要求、特に外観品質要求や、欧米との品質規格の相違から、日本の承認規格や要求レベルに適合する原薬を供給できる製造所が限定されるケースや、薬事制度の煩雑さなどから日本への原薬供給をためらう製造所も多いという現状があります。高品質の医薬品を安定して確保するためには、製造所監査の充実や技術指導の強化を図る必要がありますが、そのためにも日本のバイイングパワーを高める必要があります。
品質規格や薬事制度の見直しには、患者の安全を大前提とした十分な議論が必要です。また医療の現場の先生方のご理解も必要と考えます、これらも踏まえ、原薬の安定確保の観点から、改めて品質規格や薬事制度を再確認するような議論があってもよいのではないかと考えます。
以上
本コラムは、第95 回日本感染症学会学術講演会/第 69 回日本化学療法学会総会合同学会(令和3年5月7~9日, パシフィコ横浜) シンポジウム4「抗菌薬の安定供給の現状、課題、対応について」にて、「日本における医薬品の安定供給に関する課題と対応」として発表した内容をまとめたものです。